
近日,华南师范大学环境学院应光国教授团队2021级博士生卢志杰、史文俊副研究员等人在《Environmental Science & Technology》上发表了题为“Benzimidazole fungicide carbendazim induces gut inflammation through the TLR5/NF-κB pathway in grass carp”的论文(DOI: 10.1021/acs.est.4c12695)。该论文通过苯并咪唑类杀菌剂多菌灵对草鱼进行42天暴露,发现环境相关浓度下的多菌灵会激活TLR5/NF-κB通路诱导草鱼肠炎发生,进一步破坏肠道四大屏障如:机械、化学、免疫和微生物屏障,从而导致短链脂肪酸代谢紊乱。该研究表明水生环境中的苯并咪唑类杀菌剂多菌灵可通过TLR5/NF-κB通路介导鱼类的肠炎发生,对鱼类健康具有较高生态风险。
图文摘要
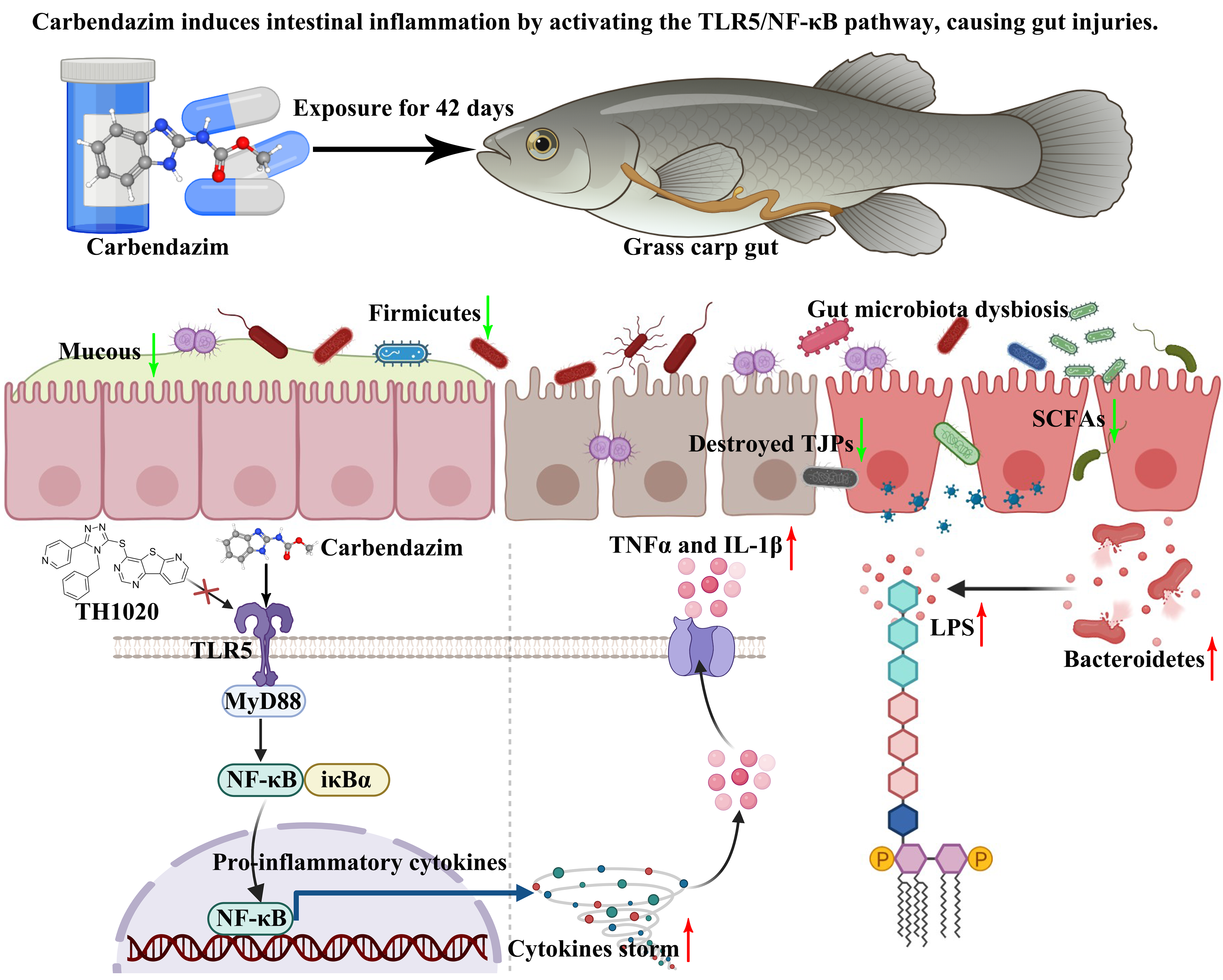
全文速览
杀菌剂在农业和纺织等领域的应用日益广泛。这类化学物质的杀菌特性可能会破坏肠道菌群的稳态,进而损伤肠道的健康。本研究以环境相关浓度(0.2,2和20 μg/L)的常用杀菌剂多菌灵暴露草鱼42天,通过组织病理学观察、mRNA与蛋白表达分析、生化检测,结合短链脂肪酸(SCFAs)、细胞因子、脂多糖(LPS)定量及16S rRNA与ITS测序等技术,系统解析了其对草鱼肠道结构损伤与代谢功能紊乱的毒理效应与分子机制。本研究结果显示,环境相关浓度下的多菌灵可强烈诱导肠道炎症,显著升高Toll样受体5(TLR5)/核因子κB(NF-κB)通路关键基因(TLR5、NF-κB、IL-1β和TNFα)的转录与翻译水平;同时,破坏肠道屏障,导致紧密连接蛋白(occludin和ZO-1/2)、杯状细胞及免疫球蛋白IgM含量显著降低;并引发肠道菌群稳态失调,造成SCFAs水平下降与LPS含量升高等代谢紊乱。值得注意的是,TLR5拮抗剂TH1020处理可有效缓解多菌灵诱导的肠道炎症,改善机械屏障功能。综上所述,本研究揭示了多菌灵可通过TLR5/NF-κB信号通路损害鱼类肠道健康的毒性机制,证实其对非靶标生物也具有显著生态风险。鉴于该污染物经常在环境中被广泛检出,该研究结果可为评估多菌灵污染的水体对鱼类肠道健康的生态风险提供了重要科学依据。
引言
多菌灵是一种苯并咪唑类杀菌剂,广泛应用于农业领域以保护蔬菜、水果、棉花及谷物免受真菌病害和虫害侵袭。此外,它还被用作纺织、涂料、皮革等行业的防腐剂。凭借其价格便宜、广谱抗真菌与杀虫效能,以及强抗菌特性,多菌灵已经在印度(年产量约1,000吨)、中国(年产量2,071吨)、阿根廷、巴西、越南、荷兰、德国和美国等国家实现大规模的生产与应用。然而,由于常规污水处理工艺对多菌灵的去除率极低(0-38%),导致其在水体环境中被频繁检出如:地表水、地下水、市政污水、海水及饮用水中的浓度范围为0.003-200 μg/L,其中欧洲地区检测值为0.60-6.00 μg/L,南美与中国地表水最高浓度分别达4.50 μg/L和> 1.00 μg/L。多菌灵具有极强的环境稳定性,其苯并咪唑环结构难以降解,导致地表水中半衰期长达2年以上。研究表明,该污染物可在鱼类肝脏(0.25-1.02 ng/g)和肌肉组织(0.12-0.71 ng/g)中蓄积,通过食物链污染最终经长期膳食摄入直接威胁人体健康。值得注意的是,茶叶、蔬菜、蜂蜜、水果、鱼类及红酒等日常食品中亦普遍检出多菌灵残留,使其成为这些产品中最常检出的农药污染物之一。
胃肠道作为多菌灵残留经摄食吸收的主要靶器官,在食物消化及营养/污染物吸收中具有核心作用。肠道菌群(含细菌与真菌)在此过程中发挥关键调控功能。由于多菌灵具有杀菌特性,其进入肠道后可能会干扰肠道真菌(甚至细菌)的生态平衡,诱发肠道菌群和代谢紊乱。已有研究证实,抑霉唑(imazalil)和霜霉威(propamocarb)杀菌剂可导致肠道菌群稳态失调与代谢异常。此外,我们先前的研究也发现唑类抗真菌剂氯咪巴唑也会导致鱼类的肠道菌群稳态失调和SCFAs代谢紊乱。这种对菌群的潜在扰动效应使胃肠道成为研究多菌灵肠道毒性的首要靶器官。菌群失调可通过释放过量脂多糖(LPS)、肿瘤坏死因子α(TNFα)、白细胞介素1β(IL-1β)等促炎因子诱发肠道炎症,同时通过降低短链脂肪酸(SCFAs)水平导致代谢紊乱。最新研究表明,Toll样受体(TLR)/核因子κB(NF-κB)信号通路是污染物如:全氟化合物(poly- and perfluoroalkyl substances)和三氯卡班(trichlorocarban)激活的关键通路,这些污染物通过氢键与盐桥作用模拟TLR激动剂,与受体结合后引发炎症级联反应。然而,环境真实浓度下的多菌灵诱导肠道炎症的毒理效应与分子机制仍没有被阐述清楚。因此,本研究提出科学假设:环境相关浓度的多菌灵通过激活TLR5/NF-κB信号通路诱发肠道炎症,最终导致肠道结构损伤与功能异常。
当前,多菌灵引发的环境污染及其对非靶标生物(尤其是水生生物)的健康风险已引起广泛关注。鉴于其已被证实的生殖内分泌毒性、发育毒性及免疫毒性等负面效应,美国、澳大利亚及欧盟等国家/地区已明令禁用该农药。因此,探究环境浓度水平下杀菌剂的潜在毒理效应具有重要科学意义。本研究通过将草鱼暴露于环境真实浓度的多菌灵42天后,系统地评估其对肠道损伤的毒理效应并验证提出的科学假设。选择鱼类肠道而非鳃(其主要功能是呼吸与离子调节器官)作为主要研究对象,其科学依据在于鱼类胃肠道在水体污染物的摄取与吸收过程中具有更显著的生理学意义。例如,具有特殊消化吸收功能的肠道是氯硝柳胺和硒等污染物富集与毒性效应的关键靶器官。通过解析肠道损伤机制,可更全面了解多菌灵暴露对鱼类健康的危害,为评估其水生生态系统风险提供关键科学依据。本研究综合运用组织病理学观察、mRNA与蛋白表达分析、化学检测、生化分析、16S核糖体RNA(rRNA)与内部转录间隔区(ITS)高通量测序、短链脂肪酸(SCFAs)定量及相关性网络分析等技术,深入阐明多菌灵诱导肠道炎症的分子机制;并通过TLR5拮抗剂TH1020干预实验,确证TLR5/NF-κB通路介导的肠道炎症分子机制。本研究揭示该杀菌剂的毒理效应与分子机理,为环境污染物毒性机制研究提供了新的见解。
图文导读
1. 多菌灵增加TLR5/NF-κB通路相关基因的mRNA和蛋白质水平
本研究使用qPCR和组织免疫荧光染色实验,研究了TLR5激活是否有助于增强iκBα和NF-κB的转录和翻译。结果显示,在三个多菌灵浓度暴露组中,iκBα和NF-κB的mRNA和蛋白质水平显著增加。例如,TLR5/NF-κB通路相关基因的转录水平在FG、MG和HG组中均有所提高,特别是tlr5、髓样分化原始反应蛋白88(myd88)、抑制因子κB激酶亚基α(ikkα)、抑制因子κB激酶亚基β(ikkβ)、抑制因子κB激酶亚基γ(ikkγ)、转化生长因子β激活激酶1(tak1)、核因子κB(nf-κb)、肿瘤坏死因子α(tnfα)和C-C基序趋化因子配体1(ccl-1)(p < 0.05;见图1A,S3A-B)。此外,NF-κB、TLR5和iκBα的蛋白表达水平在FG、MG和HG组中分别上调了1.56–2.38倍(p < 0.01;见图1B-D,S3C-H,S4-5)。
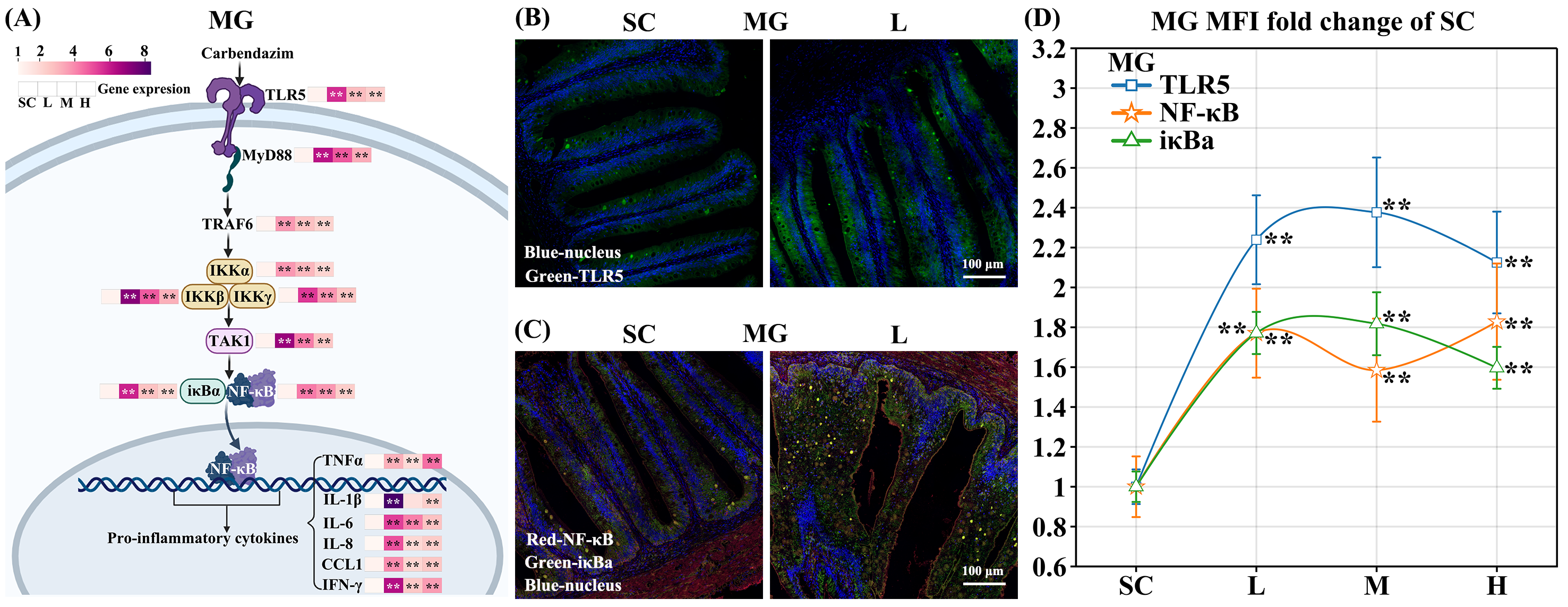
图1. 多菌灵暴露草鱼激活TLR5/NF-κB通路。
2. 多菌灵损伤肠道四大屏障
(1) 机械屏障:在L、M和H处理组中,草鱼FG、MG和HG的绒毛长度、宽度和肌肉厚度都有所下降(p < 0.01;图2A、F、S6A、G和S7)。在三个浓度多菌灵暴露组中,紧密连接蛋白相关基因的转录水平被抑制了约22-80%,尤其是occludin和zo-1/2(p < 0.01:图2E和S6E-F)。ZO-1和Occludin的蛋白表达下调了约33-50%(p < 0.01;图2B、F、S6B、G和S8)。
(2) 化学和免疫屏障:在化学屏障分析中,多菌灵暴露显著减少了L、M和H处理组的杯状细胞和柱状上皮细胞数量,降幅约为12-67%(p < 0.05;图2C、F、S6C、G和S9)。在免疫屏障方面,FG、MG和HG中的mucin-2、leap-2b和igm的转录水平在三个多菌灵浓度暴露组中减少了约29-94%(p < 0.01;图S10)。在L、M和H处理组中,IgM蛋白水平和AKP酶活性下调了约27-87%(p < 0.05:图2D、F、S6D、G和S11)。
(3) 微生物屏障:关于α多样性,在FG中,H组细菌和真菌的Shannon和Chao1指数低于SC组,而在HG中则高于SC组(图S12A-D)。主成分分析(PCA)显示,FG、MG和HG中的细菌和真菌生态系统几乎完全分布在L、M和H处理中(图S12E-F)。多菌灵暴露改变了FG、MG和HG道中细菌和真菌在门和属一级的组成。在FG、MG和HG中,Bacteroidetes、Proteobacteria、Firmicutes和Fusobacteria是最主要的细菌门,而Ascomycota和Rozellomycota是最主要的真菌门(图2G-H,S6H-K)。在FG、MG和HG道中,H组的Bacteroidetes相对丰度高于SC组,但H组的Firmicutes相对丰度低于SC组(图2G)。多菌灵暴露组中肠道的Firmicutes(F)/Bacteroidetes(B)比值下降(图S13)。多菌灵暴露后,H组FG、MG和HG中Ascomycota的相对丰度增加(图2H)。关于微生物屏障的更详细说明见附件Text S8。
3. 短链脂肪酸、细胞因子及脂多糖浓度变化与相关性分析
PCA结果显示,L、M和H浓度多菌灵暴露组中肠道SCFAs的分布特征与SC组存在显著差异(图3B)。多菌灵三个浓度暴露组中肠道的乙酸、丙酸、丁酸、异戊酸及异己酸含量均下降(p < 0.01),而戊酸在M和H组中显著升高(p < 0.01,图3A)。微生物代谢功能分析进一步表明,与乙酸、丙酸及丁酸生成相关的关键酶(乙酸激酶、乙酸CoA转移酶、丙酸激酶、丙酸CoA转移酶、丁酸激酶和丁酸-乙酰乙酸CoA转移酶)活性也显著降低(图S17)。
偏最小二乘判别分析(PLS-DA)模型显示,多菌灵暴露组与对照组中的SCFAs代谢轮廓显著分离(R²=0.99,Q²=0.98)。Q²在Y轴的截距小于0(图S18A),表明模型无过拟合风险。通过变量投影重要性得分(VIP ≥ 1)及显著性检验(p < 0.05),确定丙酸、丁酸、异己酸与戊酸为关键生物标志物(图S18B)。M和H组肠道TNFα、LPS及IL-1β含量显著上调(p < 0.05,图3D)。相关性网络分析揭示肠道菌群丰度与屏障功能、炎症反应及SCFAs变化存在显著关联如:机械屏障(muscularis thickness)与化学屏障(columnar epithelial cells)分别与肠道微生物Macellibacteroides和Penicillium呈强正相关(r > 0.8,p < 0.05,图3E)。关于相关性的更详细说明信息见附件Text S9。
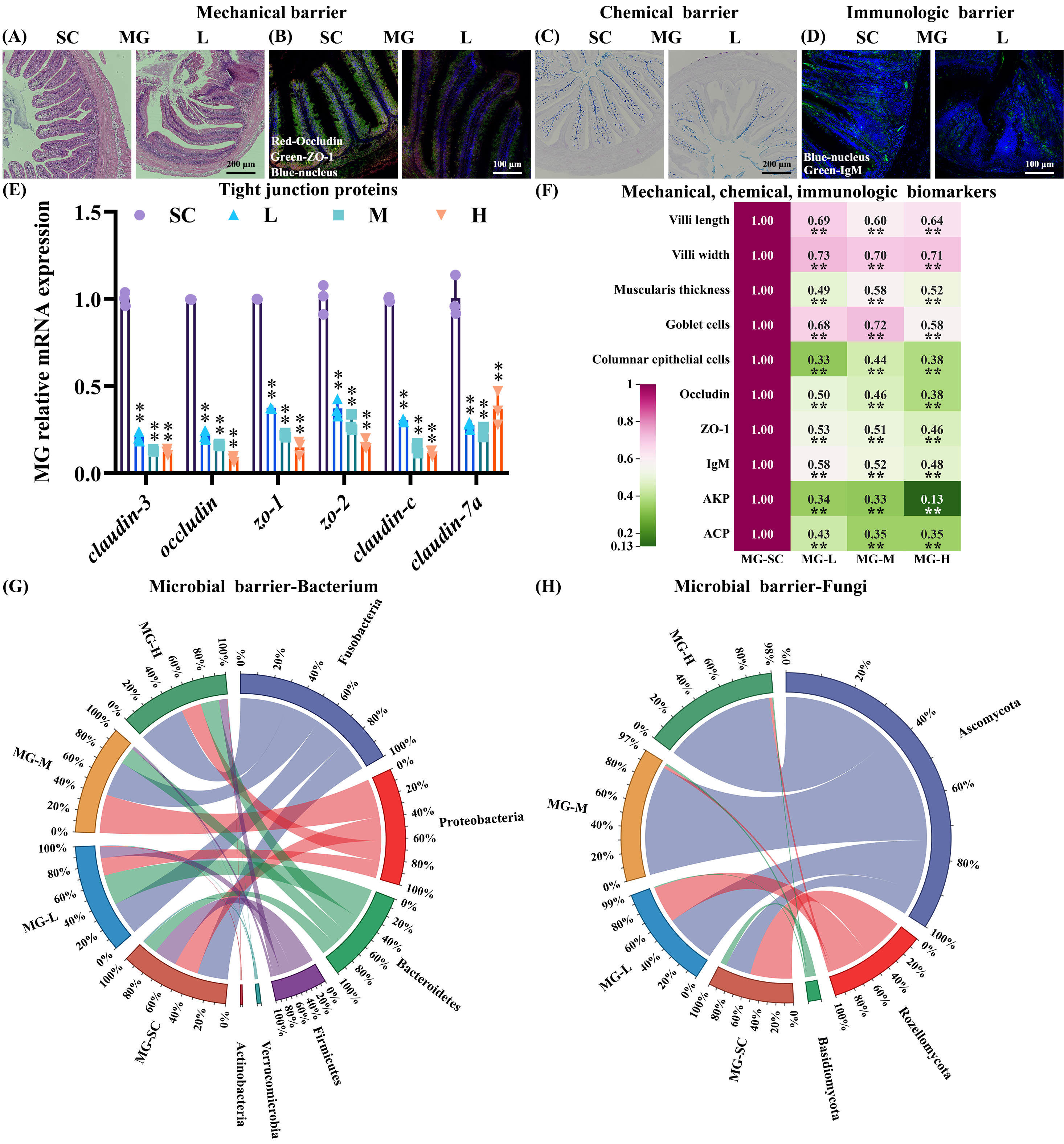
图2. 暴露于多菌灵42天的草鱼中肠的机械、化学、免疫和微生物屏障。
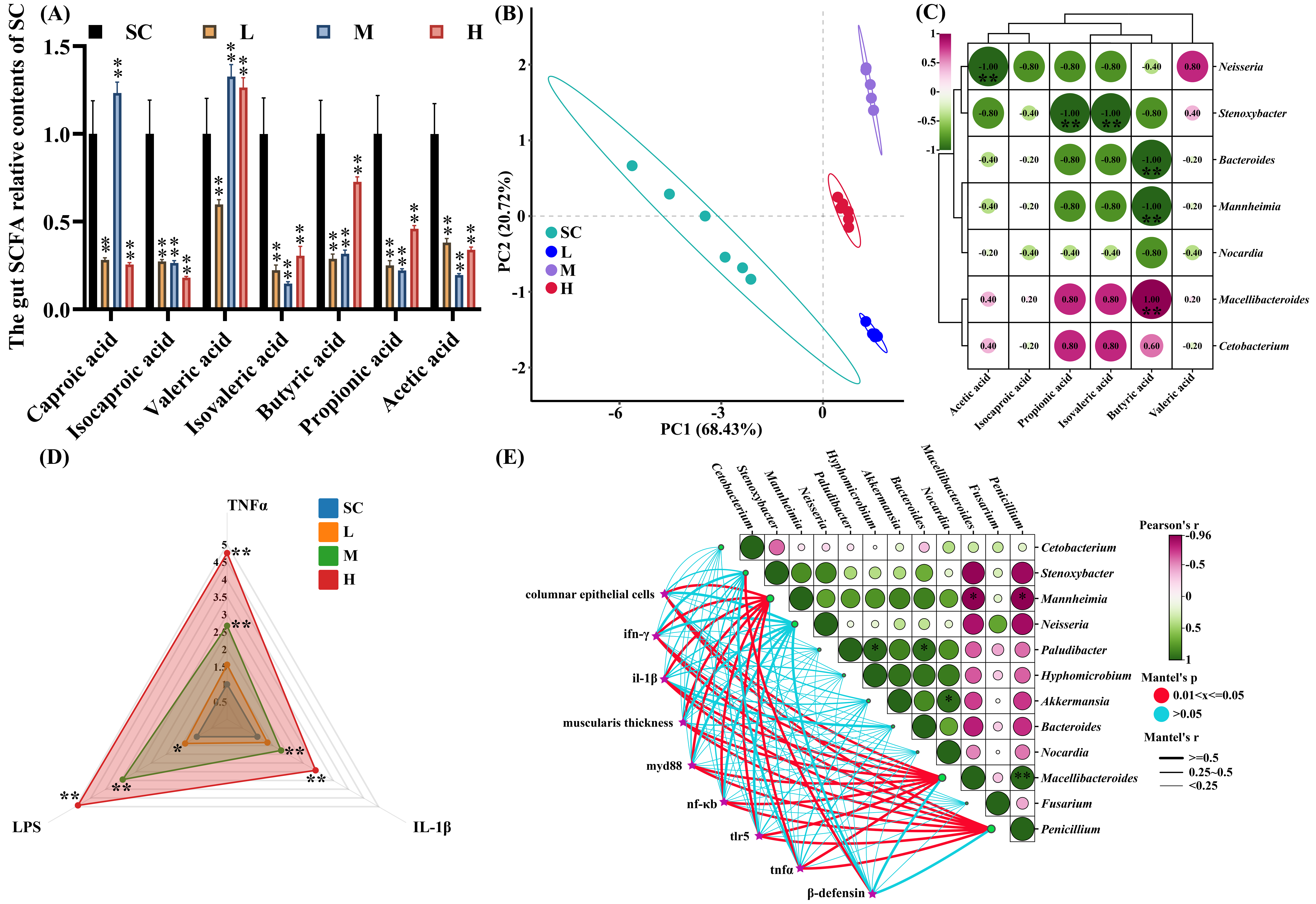
图3. 肠道代谢和相关性分析。
4. 验证TLR5/NF-κB通路在肠道炎症中的作用
为进一步研究多菌灵诱导草鱼肠道炎症的分子机制,本研究使用了TLR5拮抗剂TH1020(图4A)。根据Bliss独立性模型分析,与单独暴露于多菌灵相比,多菌灵与TH1020联合处理对TLR5/NF-κB通路产生了拮抗作用(表S4)。如图4B-C所示,CBD-L和CBD-H + TH1020联合处理组中,TLR5/NF-κB通路相关基因的转录水平较单独CBD-L或CBD-H处理组有所下降(图S19,20A-B)。TLR5、NF-κB和iκBα蛋白的水平(图4D-E,S19,20C-E和S21)在FG、MG和HG组中也有所降低。组织病理学检查显示,TH1020处理有效防止了多菌灵暴露引起的机械屏障损伤(图S22-23)。紧密连接基因,包括occludin和ZO-1,在mRNA和蛋白水平上均在TH1020处理组中有所上升,相较于单独暴露于多菌灵的组(图S24)。
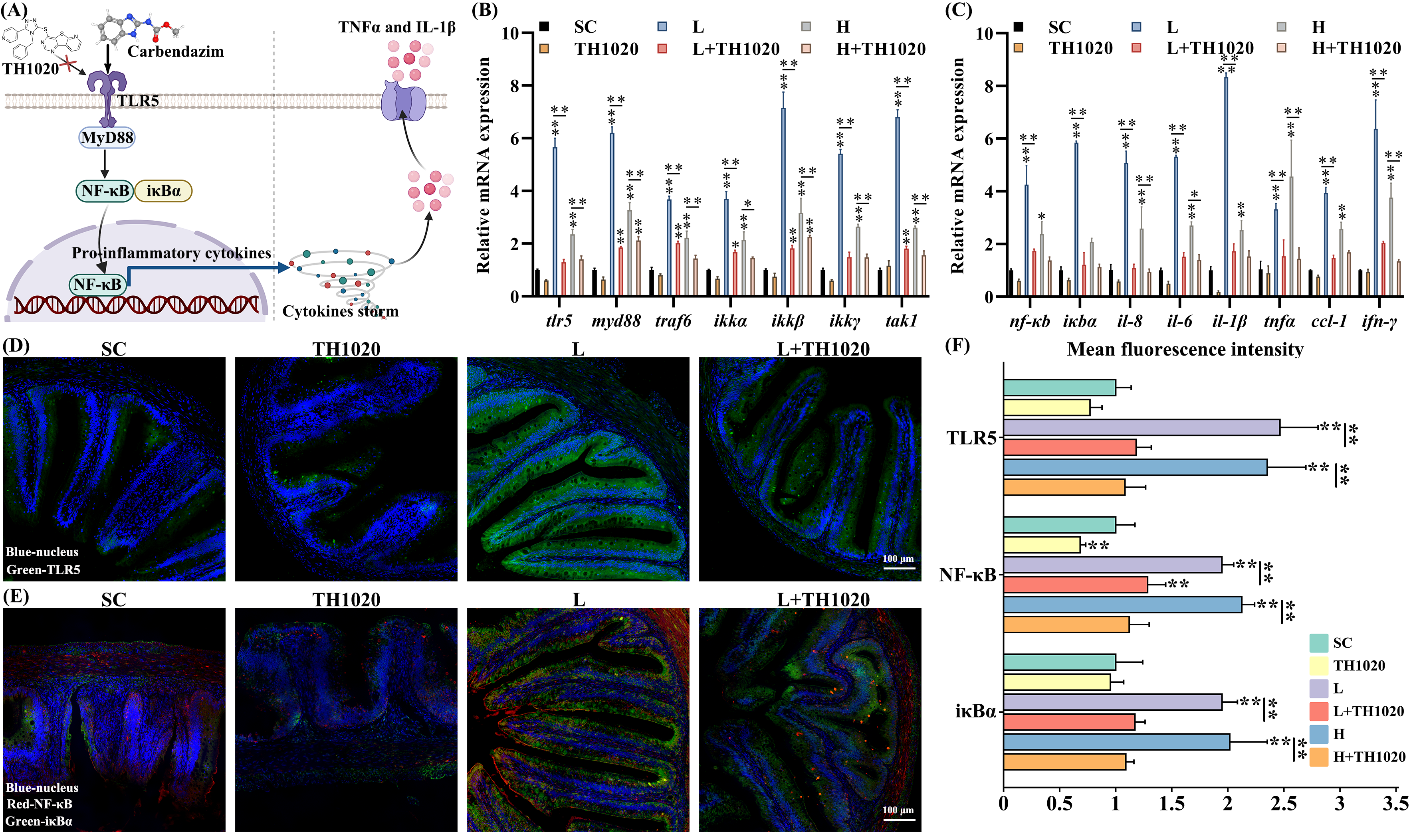
图4. TLR5拮抗剂TH1020验证了介导MG肠道炎症的TLR5/NF-κB信号通路。
结论与意义
本研究的结果系统地揭示了多菌灵可通过激活TLR5/NF-κB通路引起草鱼肠道炎症的毒性机制,导致草鱼肠道形态受损和代谢功能异常。肠道作为鱼类消化系统的重要组成部分,其健康状态直接影响到鱼类的生长发育和生存能力。肠道损伤可能导致鱼类生长缓慢、繁殖能力下降、易感性增加和死亡率上升。其次,鱼类是水生生态系统的重要组成部分,其健康直接影响生态链的稳定性。例如,鱼类种群的不稳定性可能导致捕食者与猎物比例失衡,从而破坏整个生态系统的稳定性。作为四大家鱼之一的草鱼是水生生态系统中的重要组成一员,其健康状态直接影响到生物的多样性,甚至整个生态系统的稳定性。多菌灵的大量和频繁地使用不仅对单一非靶标生物如草鱼构成威胁,还可能对整个水生生态系统产生广泛的不良影响;特别是考虑到多菌灵在水生环境中的广泛与频繁检测和降解的持久性,其对自然生态系统的潜在风险不容忽视。综上所述,本研究的结果不仅揭示了多菌灵诱导草鱼肠道炎症的分子机制,还进一步分析了其对鱼类生长发育、自然生态系统以及环境污染风险评估的意义;这些发现对于制定科学合理的多菌灵使用策略和环境保护措施具有重要的意义。
全文链接
Zhi-Jie Lu, Wen-Jun Shi, Lu-Kai Qiao, Dong-Dong Ma, Jin-Ge Zhang, Chong-Rui, Yao, Si-Ying Li, Xiao-Bing Long, Guang-Guo Ying. Benzimidazole fungicide carbendazim induces gut inflammation through the TLR5/NF-κB pathway in grass carp. Environmental science & technology, 2025, 59, (5), 2473-2483. https://pubs.acs.org/doi/10.1021/acs.est.4c12695
Zhi-Jie Lu, Wen-Jun Shi, Fang-Zhou Gao, Dong-Dong Ma, Jin-Ge Zhang, Si-Ying Li, Xiao-Bing Long, Qian-Qian Zhang, Guang-Guo Ying. An azole fungicide climbazole damages the gut-brain axis in the grass carp. Journal of Hazardous Materials. 465, 133463, ISSN 0304-3894. https://doi.org/10.1016/j.jhazmat.2024.133463
Zhi-Jie Lu, Wen-Jun Shi, Fang-Zhou Gao, Dong-Dong Ma, Jin-Ge Zhang, Si-Ying Li, Xiao-Bing Long, Qian-Qian Zhang, Guang-Guo Ying. Climbazole causes cell apoptosis and lipidosis in the liver of grass carp. Aquat Toxicol. 2023 Oct; 263:106698. https://doi.org/10.1016/j.aquatox.2023.106698.